Tabla de Contenidos
Aunque los desarrolladores de medicamentos han logrado algunos avances en el tratamiento de la enfermedad de Alzheimer con medicamentos que reducen la proteína beta amiloide, otros problemas de la enfermedad, incluida la inflamación, continúan sin control. En un nuevo estudio, los científicos del Instituto Picower para el Aprendizaje y la Memoria del MIT describen un fármaco candidato que en cultivos de células humanas y modelos de ratón con Alzheimer redujo la inflamación y mejoró la memoria.
El objetivo de la nueva molécula «A11» es un factor de transcripción genético llamado PU.1. Investigaciones anteriores han demostrado que, en medio de la enfermedad de Alzheimer, PU.1 se convierte en un director demasiado entusiasta de la expresión de genes inflamatorios en las células inmunes de la microglía del cerebro. A11 suprime esta problemática actividad de PU.1, según muestra la nueva investigación, mediante el reclutamiento de otras proteínas que reprimen los genes inflamatorios que PU.1 trabaja para expresar.
Pero debido a que A11 se concentra principalmente en el cerebro y no reduce los niveles de PU.1, no parece alterar la otra función de PU.1, que es asegurar la producción de una amplia variedad de células sanguíneas.
«La inflamación es un componente importante de la patología de la enfermedad de Alzheimer que ha sido especialmente difícil de tratar», dijo el autor principal del estudio, Li-Huei Tsai, profesor Picower de Neurociencia en el MIT y director del Instituto Picower y de la Iniciativa Cerebral Envejecido del MIT. «Este estudio preclínico demuestra que A11 reduce la inflamación en células similares a la microglía humana, así como en múltiples modelos de ratón de la enfermedad de Alzheimer, y mejora significativamente la cognición en los ratones. Creemos que, por lo tanto, A11 merece un mayor desarrollo y pruebas».
Tsai y Elizabeta Gjoneska de los Institutos Nacionales de Salud son coautores correspondientes del estudio publicado en el Journal of Experimental Medicine .
Como postdoctorado, Gjoneska codirigió un estudio de 2015 que implicaba a PU.1 como un regulador de la inflamación de la microglía errante en un modelo de ratón de la enfermedad de Alzheimer. Esa investigación fue una colaboración entre el laboratorio de Tsai y el del profesor de Ciencias de la Computación del MIT Manolis Kellis, codirigido por el ex postdoctorado Andreas Pfenning, ahora miembro de la facultad de la Universidad Carnegie Mellon. Desde entonces, Tsai ha estado buscando una forma segura de restaurar la actividad de PU.1 a niveles más saludables.
El trabajo descrito en el nuevo artículo, dirigido por el científico investigador del Instituto Picower William Ralvenius, comienza con experimentos para validar aún más que PU.1 sería un objetivo terapéuticamente significativo. Para ello, los científicos compararon la expresión genética en células inmunitarias de muestras de cerebro postmortem de pacientes con Alzheimer y modelos de ratón y controles coincidentes sin Alzheimer.
Las comparaciones mostraron que el Alzheimer produce cambios importantes en la expresión del gen microglial y que un aumento en la unión de PU.1 a objetivos de genes inflamatorios fue un componente significativo de ese cambio. Además, demostraron que la reducción de la actividad de PU.1 en un modelo de ratón con Alzheimer reducía la inflamación y la neurodegeneración, es decir, la muerte de las neuronas.
Éxito de la detección
Derribar genéticamente PU.1 en el cuerpo no es una estrategia terapéutica viable dada su importancia en el funcionamiento normal y saludable. Por lo tanto, el equipo examinó más de 58.000 moléculas pequeñas de bibliotecas de medicamentos y nuevos productos químicos aprobados por la FDA para ver si alguna podía reducir de manera segura y significativa la inflamación clave y los genes relacionados con el Alzheimer regulados por PU.1 en cultivos celulares. Después de varias rondas de análisis cada vez más estrictos, redujeron el campo a seis sustancias químicas. A11 fue, con diferencia, el más potente de ellos.
Probaron los efectos de dosis de A11 sobre la función de células similares a la microglía humana cultivadas a partir de células madre de pacientes. Cuando expusieron las células similares a la microglía a moléculas inmunes que normalmente desencadenan la inflamación, las células tratadas con A11 mostraron una expresión y secreción reducidas de citocinas inflamatorias y menos cambios en la forma del cuerpo celular asociados con las respuestas inflamatorias de la microglía.
Las células también mostraron una menor acumulación de moléculas lipídicas, otro signo de activación inflamatoria. Al observar los patrones de expresión genética, los científicos observaron que las células tratadas con A11 expuestas a desencadenantes inflamatorios se comportaban de manera muy similar a la microglía imperturbada, lo que sugiere que A11 ayuda a evitar que la microglía reaccione exageradamente a las señales inflamatorias.
Dos pruebas de laboratorio más destinadas a comprender cómo ejerce sus efectos el A11 revelaron que no cambia los niveles de PU.1. En cambio, contrarresta la actividad de PU.1 reclutando varias proteínas, incluidas MECP2, HDAC1, SIN3A y DMNT3A, que se sabe que reprimen la expresión de sus objetivos. Esencialmente en medio de la enfermedad de Alzheimer, A11 reduce lo que PU.1 amplifica.
«A11 representa una molécula primera en su clase que convierte PU.1 de un activador transcripcional a un represor transcripcional, lo que resulta en un estado controlado de inflamación microglial», escribieron los autores.
Ratones en laberintos
Habiendo establecido que A11 reducía la actividad inflamatoria en la microglia y determinado cómo sucede eso, el equipo se centró en si funcionaba como medicamento en modelos de ratón de la enfermedad de Alzheimer.
Las pruebas farmacológicas indicaron que el A11 se elimina fácilmente de los tejidos y es capaz de llegar a las células cerebrales. Además, en ratones sanos la sustancia química cruzó con éxito la barrera hematoencefálica y permaneció en las células cerebrales mucho más tiempo que en cualquier otro lugar.
Finalmente, el equipo probó los efectos de los fármacos sobre la patología y los síntomas de la enfermedad de Alzheimer en tres cepas de ratones, cada una de las cuales modela diferentes aspectos de la enfermedad de Alzheimer: ratones CK-p25 (neurodegeneración grave), ratones transgénicos Tau P301S (tauopatía) y ratones 5XFAD (amiloide). patología).
Los ratones CK-p25 machos y hembras a los que se les administró A11 mostraron menos respuesta inflamatoria entre las células de microglía y astrocitos y perdieron menos neuronas que los controles no tratados. Los ratones TauP301S Tg respondieron de manera similar, mostrando también una reducción significativa de la proteína tau fosforilada en la región del hipocampo del cerebro, que es un área esencial para la memoria. En ratones 5XFAD, el amiloide se redujo significativamente.
El equipo sometió a los ratones Tau P301S Tg y CK-p25 a laberintos diseñados para evaluar su memoria de trabajo a corto plazo y su aprendizaje a largo plazo. En ambos modelos y en ambas pruebas, los ratones tratados con A11 obtuvieron resultados significativamente mejores que los controles no tratados. Por ejemplo, en el «Morris Water Maze», donde los ratones tienen que aprender la ubicación de una plataforma sumergida que les permite descansar, los ratones tratados con CK-p25 aprendieron mucho más rápido que los no tratados.
Es necesario realizar muchas más pruebas antes de que el A11 pueda convertirse en un medicamento aprobado, dijo Tsai, pero señaló que podría complementar los nuevos tratamientos dirigidos al amiloide.
«Dado que el A11 actúa a través de un mecanismo distinto al de las terapias existentes para la EA, el A11 podría usarse solo o en combinación con terapias aprobadas para proporcionar mejores opciones de tratamiento para las enfermedades neurodegenerativas», concluyeron los autores.
Fuente: Massachusetts Institute of Technology
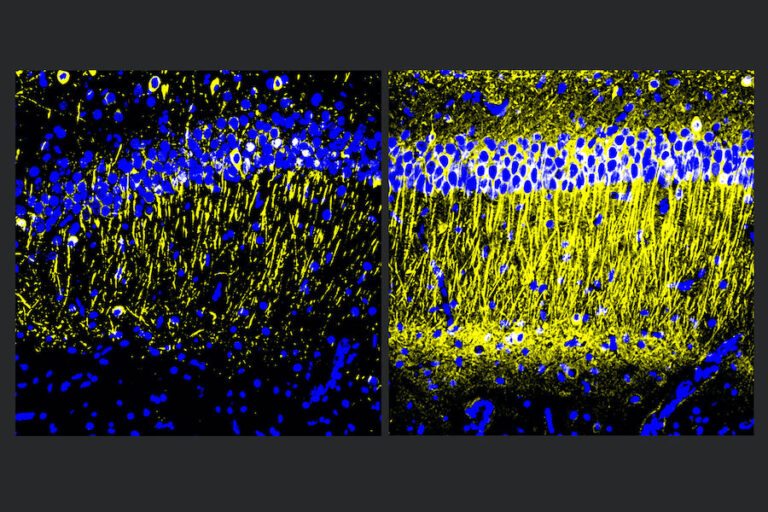
Imagen principal: Los cerebros de ratones modelo de Alzheimer tratados con A11 (derecha) mostraron más tubulina (amarillo), un marcador de salud neuronal, que los controles no tratados (izquierda). Crédito: Tsai Lab/MIT Picower Institute
Más información:
- William Ralvenius et al, A novel molecular class that recruits HDAC/MECP2 complexes to PU.1 motifs reduces neuroinflammation, Journal of Experimental Medicine (2023). DOI: 10.1084/jem.20222105